2012년 미국 소고기 수입과 함께 불거지던 광우병 논란을 기억하는가. 전문 용어로 크로이츠펠트 야콥병(CJD)이라고 불리우는 전염성 해면상뇌병증(Transmittable spongiform encephalopathy, TSE)의 일부인 이 광우병. 결국 광우병 논란은 과학적 근거의 불충분과 함께 미결로 남은 과제가 되었으나 그 원인으로 주목받으며 부상한 프리온 단백질은 1997년 프리온 단백질의 발견으로 노벨 생리학상을 수상할 만큼 오늘날까지 생명과학계의 핵심 이슈로써 남아있다. 지금부터 크로이츠펠트 야곱병, 쿠루병 등 다양한 신경 퇴행성 질환의 원인으로 지목받는 프리온 단백질에 대하여 알아보도록 하자.
프리온 단백질이란 무엇인가.
프리온 단백질은 단백질로만 이루어진 병원체이다. 프리온(prion) 단백질은 크게 정상 프리온 단백질(PrPC)와 변형 프리온 단백질(PrPSc)로 나뉜다. 정상 프리온 단백질은 이름에서 유추할 수 있듯이 생체 내에서 자연스럽게 합성하는 단백질로써 현재 그 기능에 관하여 활발한 연구가 진행되는 중이다. 반면 정상 프리온 단백질이 변형되어 형성된 변형 프리온 단백질의 경우 PRNP 유전자에 돌연변이가 발생하거나 다른 변형 프리온 단백질이 정상 프리온 단백질의 구조를 변형시켜(아직 이 과정 역시 정확하게 밝혀지지 않았다) 형성된다. 또한 우리가 광우병이라고 부르는 인간 크로이츠펠트 야콥병(vCJD)등의 주 원인으로 추정되는 단백질인데, 어떻게 이 변형 프리온 단백질이 질병을 일으키는지는 뒤에서 다루도록 하겠다.
사실 과학계에서도 프리온 단백질에 대하여 알려진 바는 많지 않다. 프리온을 최초로 발견한 것은 1960년대이며, 해당 단백질이 과학계에서 주목을 받은 지는 20여년이 채 지나지 않았다. 이러한 관계로 그 단백질 구조, 전사와 번역 과정 등은 밝혀졌지만 아직 이 프리온 단백질이 생체 내에서 어떤 분야에서 어떤 식으로 쓰이는 단백질인지는 정확한 사실로써 확실하게 검증되지 않았다. 하지만 여러 유력한 가설들과 증거들이 존재하며, 본 기사에서는 해당 가설들과 밝혀진 변형 프리온 단백질의 병리학적 특징에 중점을 둔다. 과연 어떠한 가설이 맞을지는 독자의 생명과학적 탐구력에 맡기도록 하겠다.
정상 프리온 단백질의 기능
정상 프리온 단백질의 확실한 기능에 대하여는 아직 밝혀진 바가 없으며, 과학계에서는 이에 관련하여 활발한 토론을 진행하고 있다. 하지만 그 생리학적 기능과 생체에서의 활성을 밝히기 위하여 과학자들은 정상 프리온 단백질의 발현을 억제시키거나 줄인 여러 실험동물들을 사용한 실험을 진행하고 있다. 더욱이는 포유류 이외에 다른 종, 식물이나 효모 등의 생물에서도 프리온과 유사한 구조, 형태를 지닌 프리온 단백질을 찾아냄으로써 그 기능을 유추하고 있는 단계에 있다.
최근 가장 유력하게 여겨지고 있는 정상 프리온 단백질의 기능은 신경 조직을 보호한다는 것이다. 포유류에서 프리온 단백질이 가장 많이 존재하는 곳은 신경세포 막과 골지체 등이다. 이에 많은 신경발생학자들에 의한 실험이 진행되었지만 유의한 결과가 나타나지 않았다. 하지만 Tobler교수가 1996년 논문 <Nature>에서 발표한 바에 따르면 몇몇 실험쥐에서 수면 장애와 왜곡된 생체 주기가 발견되었다고 발표하였으며, 이어 2007년 Harris D.S. 등이 <Biochimia et Biophysica Acta>에서 발표한 논문이나 2010년 Collinge 등이 <Neuropathology and Applied Biology>에서 발표한 리뷰 등에 따르면 그들은 비정상적인 행동과 인식장애를 나타냈다고 하였다. 이어서 2007년 Telling 등은 <Biochimia et Biophysica Acta>에서 성상세포 신경아교증과 뇌의 해면화를 보였다는 실험 결과를 발표하였고, 1994년 Collinge 등이 <Nature>에 발표한 논문이나 1994년 Manson 등이 <Neuroscience> 등에 발표한 논문에는 장기기억력의 상실 등과 관련되어 있다는 언급도 포함되어 있어 신경 보호의 역할을 수행하는 것이 매우 유력하게 받아들여진다. 2010년 Bremer J. 등도 <Nature Neuroscience>에서 프리온 단백질이 신경세포의 미엘린 수초를 보호한다는 보고를 하며 해당 가설을 지지한다.
특히 프리온 단백질이 신경세포의 미엘린 수초를 보호한다는 보고는 매우 설득력 있는데, 이는 프리온 단백질의 구조를 보면 알 수 있다. 2011년 Davies.P가 <Biochemistry>에 발표한 논문 등 다수의 논문이 정상 프리온 단백질 내부에는 구리 이온이 포함되어 있는데, 이 이온을 통하여 몸속에 존재하는 유해한 자유 라디칼을 분해하는 역할을 수행한다는 가설이 매우 유력하다.
일각에서는 프리온 단백질의 역할로 단백질 신호와 시냅스 가소성 조절을 지목하기도 한다. 또한 재브라피쉬에서 발견된 프리온 유사 단백질인 PrP-1과 PrP-2는 세포간 연접과 세포간 의사소통의 역할을 한다고 밝혀지기도 하여 프리온의 세포 사이 신호 전달로써의 역할 역시 프리온 단백질의 역할로 추정되고 있다. 일부 과학자들은 프리온 단백질은 면역학적 기작에서 큰 의미를 갖는다고 주장하기도 한다.
프리온 단백질과 유사한 구조를 가진 단백질은 효모나 식물, 달팽이나 곰팡이 등 포유류가 아닌 종들에서도 발견된다. 실제로 2009년 Lindquist 등이 <Cell>에 발표한 논문에 따르면 효모에 존재하는 프리온 단백질이 혹독한 환경에 적응하는데 도움을 준다고 밝혔으며 2016년에는 프리온 유사 단백질이 식물 내에서 여러 환경적 조건을 기억하는 역할을 할 수 있을 가능성에 대하여 명시하였다.

[이미지 촬영=대한민국청소년기자단 4기 백준채 기자]
이와 같은 길에서 쉽게 볼 수 있는 식물에도 우리와 같은 프리온 단백질이 들어있을지 모른다.
정상 프리온 단백질에서 변형 프리온 단백질로
위와 같이 정상 프리온 단백질은 생체 내에서 큰 위험요소가 되지 않는다. 오히려 생체에 다양한 유익한 기능을 할 것으로 예측되는 존재이다. 하지만 변형이 된다면 다르다. 변형된 프리온 단백질은 인체에 끔찍한 영향을 끼칠 수 있으며 마침내 죽음에 이르게 할 수도 있다. 지금부터 그 과정과 영향을 알아보도록 하자.
먼저 밝히고 싶은 것은 자연은 안정한 상태를 좋아한다는 것이다. 대부분의 화학 반응들은 불안정한 상태에서 안정한 상태로 변화시키고자 하는 움직임의 일환이며 이를 거스르기는 쉽지 않다. 프리온 단백질도 자연의 일부인 만큼 같은 맥락으로써 이해할 수 있다.
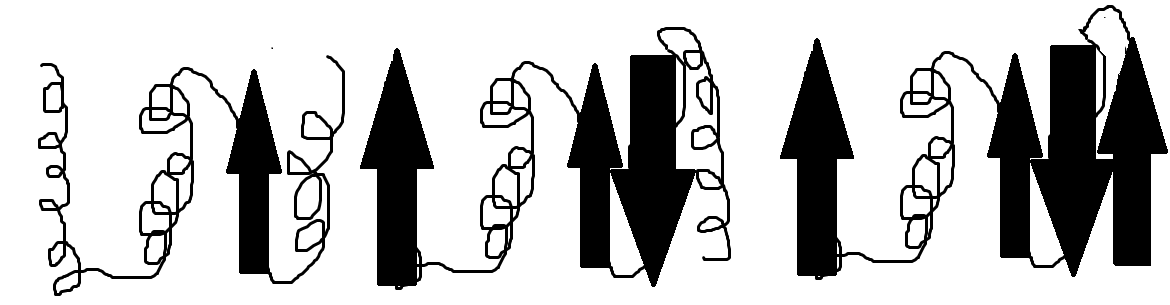
[이미지 촬영=대한민국청소년기자단 4기 백준채 기자]
위 그림은 필자가 독자의 이해를 돕기 위하여 그린 그림이다. 좌측이 정상 프리온 단백질, 우가운데가 중간체, 우측이 변형 프리온 단백질이다. 꼬인 구조는 생명과학에서 알파-나선 구조라고 부르는 구조이며 화살표는 베타-병풍 구조라고 부르는 구조이다.
정상 프리온 단백질이 변형 프리온 단백질로 변형되는 이유는 대략 두 가지 메커니즘을 통하여 소개할 수 있다. 첫 번째 메커니즘은 변형 프리온 단백질이 정상 프리온 단백질의 재접힘을 일으키는 기질의 역할을 한다는 것이다. 변형 프리온 단백질은 반응의 에너지 장벽을 낮추는 촉매의 역할을 하게 된다는 것이 핵심이다. 형성된 변형 프리온 단백질이 주변의 정상 프리온 단백질의 접힘(형성) 과정에서 일어나는 다단계 반응에서 오류를 일으키고, 이는 잘못된 접힘을 이끌어내어 결국 변형 프리온 단백질이 형성된다는 것이다.
두 번째 메커니즘은 열역학적 원리를 응용한 것이다. 정상 프리온 단백질은 자유자재로 중간체로 변할 수 있으며, 이 반응은 가역적이다. 그러나 응집된 변형 프리온 단백질 덩어리가 떠다니다가 중간체의 프리온 단백질을 만나게 되면 중간체는 변형 프리온 단백질로 변화하는 것이 더욱 열역학적으로 안정하게 되고, 결국 변형되는 것이다. 응집된 변형 프리온 단백질 덩어리는 그 자체로 안정하기 때문에 중간체 혹은 정상 프리온 단백질로 다시 변화할 수 없다.
위의 두 메커니즘은 모두 변형 프리온 단백질이 기존에 존재하여야 한다는 가정을 전제하고 있다. 그렇다면 최초의 변형 프리온 단백질은 어디에서 오는 것인가. 인간의 PRNP유전자에 변형이 일어날 경우 변형 프리온 단백질이 형성될 수 있다. 또한 과거 뉴스 등에서 언급했듯이 변형된 프리온 단백질을 체내로 가져오게 된다면 그 역시 최초의 프리온 단백질이 될 수 있다.
변형 프리온 단백질이 일으키는 질환
변형 프리온 단백질이 그렇게 문제가 된다면 과연 일으키는 질환은 무엇일까. 위의 그림과 같이 변형 프리온 단백질은 알파-나선 구조가 잘못 접혀 결과적으로 베타-병풍 구조를 상당히 많이 가지는데, 이는 유기화학 분야에서 아밀로이드 구조라고 부른다. 이 아밀로이드 구조는 생체 내에서 난공불락이다. 생체 내에는 이런 변형 프리온 단백질을 제거할 방법이 없으며, 결국 계속 세포 안에 쌓이다가 그 세포를 죽이고 마는 것이다.
프리온 단백질은 주로 포유류의 신경세포에 많이 존재하고, 따라서 주로 신경퇴행성 질환을 일으킨다. 동물에서는 사슴과 순록 등의 중추신경계에 손상을 입혀 광범위한 파괴를 낳아 뇌의 해면화를 일으키는 만성 소모성 질병(CWD), 소에서 소 해면상뇌병증(BSE)를 일으킨다. 인간에서는 1950년대 대두되었던 파푸아뉴기니의 포어족이 가지고 있었던 신경세포의 파괴로 인하여 근육의 마비와 경련을 일으키며 죽음에 달하게 하는 ‘쿠루병’과 기억력 손상, 치매, 불면증, 우울증 등을 일으키는 크로이츠펠트 야콥병(CJD)과 ‘인간광우병’이라고 불리는 변형-크로이츠펠트 야콥병(vCJD) 등이 있다. 이 외에도 게르스트만 슈트라우슬러 샤인커병(Gerstmann Straussler Scheinker disease), 치명적 가족성 불면증(FFI)등이 있다. 이 외에도 다양한 질환이 존재한다.
프리온 질환의 치료법과 연구 동향
비록 오랜 기간동안 프리온 질환에 대하여 연구가 되지는 않았지만 그 치료법을 개발하기 위한 다양한 노력이 있었다. 화학적인 요법의 경우 pentosan polysulfate, quinacrine, amphotericin B 등의 물질이 크로이츠펠트-야콥병에 효과적일 것으로 추측된다. 하지만 충분한 임상실험이 진행되지 않은 경우도 많으며 인체에 부작용이 있을 가능성이 높게 판단되어 아직까지는 현실적인 치료 방법이라 제시하기 어렵다.
다른 질병들과 같이 면역학적 요법을 이용하여 프리온 질환에 대처하기 위한 노력도 현재진행형이다. 체내의 프리온 대처를 위하여 면역계를 강화시키는 방법도 연구 중이며 변형 프리온 단백질 혹은 앞서 설명하였던 것과 같은 아밀로이드 구조를 가진 단백질만을 추적할 수 있는 기술 또한 개발 중이다. 항체와 백신을 개발하기 위한 노력도 계속되고 있으며 수지상세포와 T 세포 등의 면역세포를 이용하고자 하는 노력 또한 계속되고 있다. 실제로 쥐에서는 백신을 발견하였다는 연구 결과도 있으나 이를 지지하는 다른 연구 결과가 나오기를 기다려야 할 것이다.
알츠하이머, 파킨슨 병, 헌팅턴 병, 근위축성 측색경화증(루게릭 병)등의 대표적인 신경퇴행성 질환과 프리온 단백질의 연관성 역시 계속 연구되고 있으며 프리온 단백질의 치료 수단 역시 끊임없이 개발되고 있는 중이다. 아직까지 부작용이 효용성보다 더 큰 등 뚜렷한 효과를 드러내는 치료 방법이 있지는 않지만 지금까지 불치병으로만 알려지던 여러 질환들의 원인을 파악하였으므로 꾸준한 연구를 통하여 우리 인간은 프리온성 질환을 어느 날에는 이겨낼 수 있으리라 믿는다.
[대한민국청소년기자단 IT과학부=4기 백준채 기자]







 눈의 의지로 별을 기리다.
눈의 의지로 별을 기리다.
 “어른이 되는 게 무서워요” …… 현실이란 틀 안에 갇혀버린 학생들
“어른이 되는 게 무서워요” …… 현실이란 틀 안에 갇혀버린 학생들


